技術(shù)原理
|
|
細(xì)胞和組織獲取系統(tǒng)(CTAS)——基于毛細(xì)管的真空脈沖輔助技術(shù)
UnipicK+單細(xì)胞采集和組織顯微切割儀�����,在已獲專利保護(hù)的“細(xì)胞和組織獲取系統(tǒng)(CTAS)”基礎(chǔ)上,采用基于毛細(xì)管的真空脈沖輔助技術(shù)——以真空脈沖負(fù)壓為動(dòng)力�����,玻璃毛細(xì)管為工具����,在顯微鏡直接觀察下����,根據(jù)細(xì)胞形態(tài)、熒光標(biāo)記����、解剖學(xué)特征或特定位置,從貼壁����、懸浮和3D立體培養(yǎng)的細(xì)胞中快速精確地采集單細(xì)胞或細(xì)胞克隆,或者從組織切片中顯微切割特異性組織區(qū)域����。
UnipicK+的主要組成部件包括:頂部帶有可調(diào)節(jié)LED環(huán)形燈的操作頭����,真空管路和電纜����,帶有真空模塊的控制箱(配備數(shù)字化的操作界面),以及可將設(shè)備安裝于大多數(shù)倒置顯微鏡上的通用型支架����。使用時(shí),在取樣器頭部安裝即用型一次性毛細(xì)管單元(DCU)����,通過操控DCU做垂直運(yùn)動(dòng),為校準(zhǔn)和采樣提供精確定位����;取樣器頭部的LED環(huán)形燈可用于照亮組織樣本;真空模塊包含電子控制裝置和帶氣動(dòng)管道的真空泵����;真空強(qiáng)度����、持續(xù)時(shí)間以及LED燈強(qiáng)度均可按實(shí)際操作需要進(jìn)行調(diào)節(jié)����。
|
|

|
|
|
|

|
|
產(chǎn)品應(yīng)用/特點(diǎn)
|
|
UnipicK+應(yīng)用
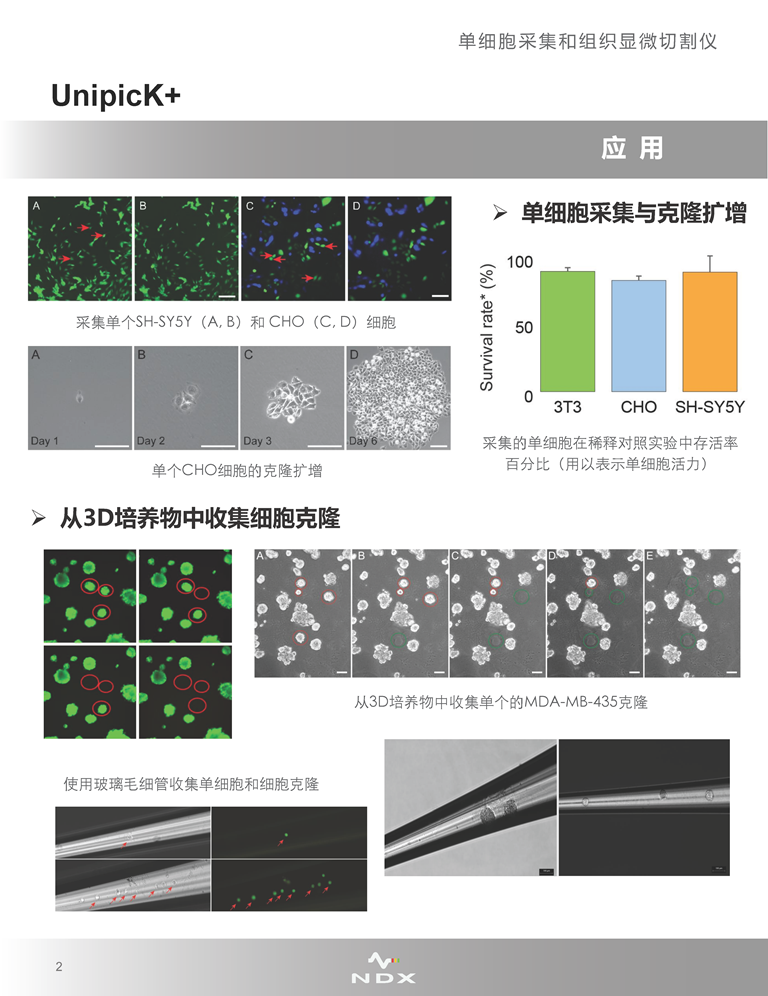
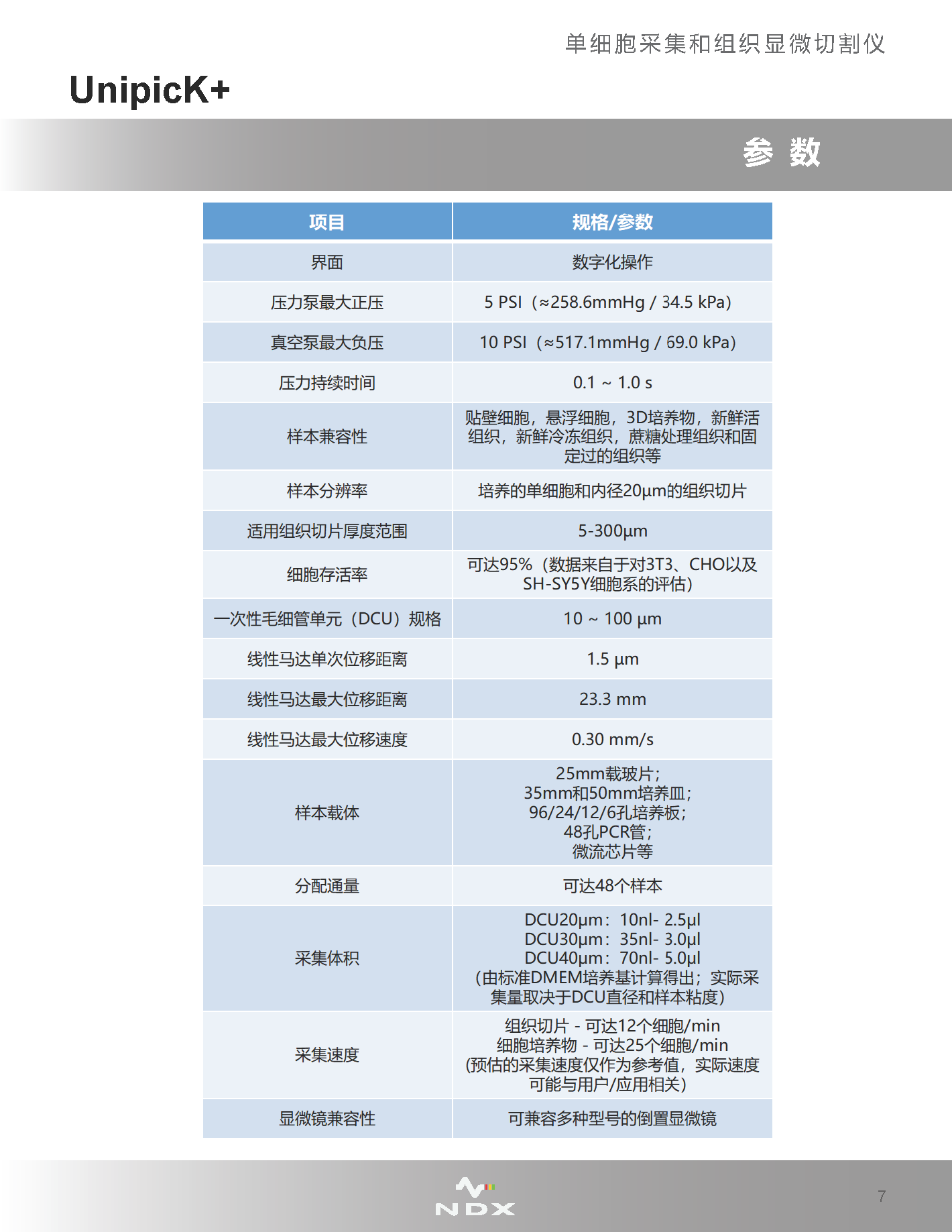
·單細(xì)胞采集
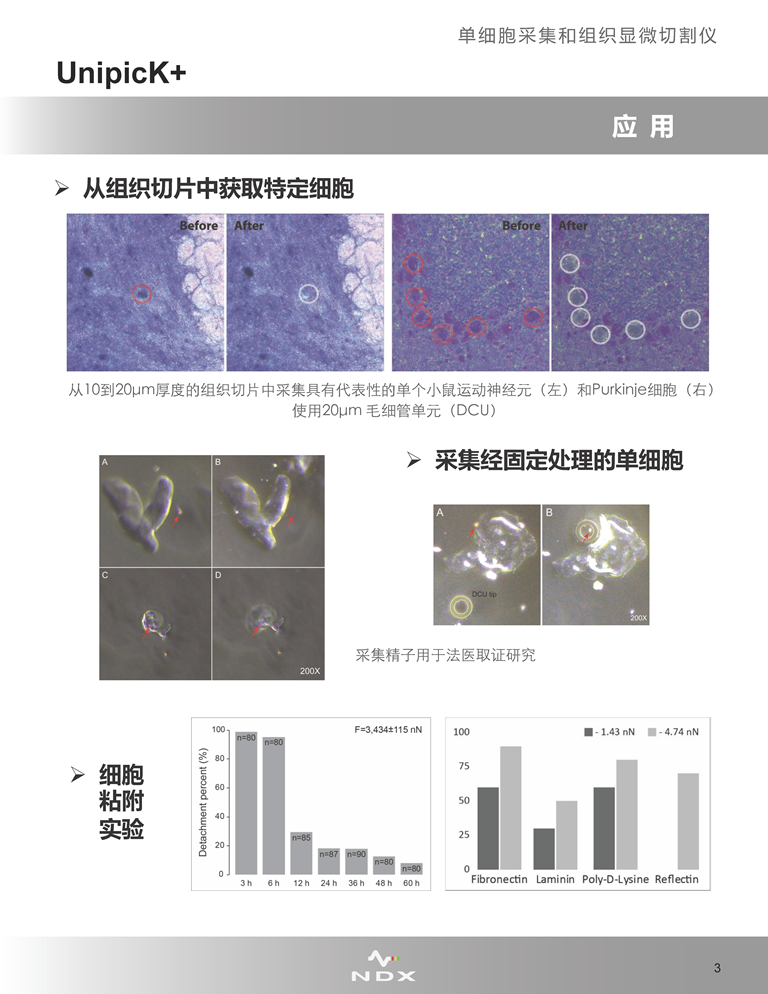
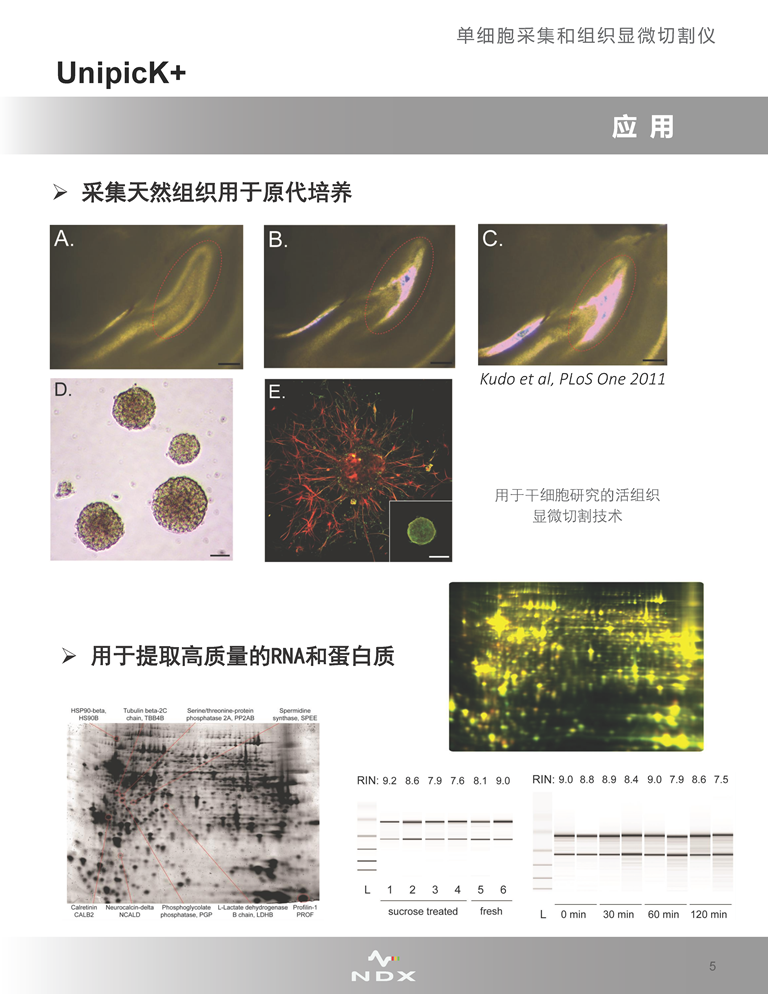
UnipicK+可從細(xì)胞培養(yǎng)皿/板或組織切片中采集單個(gè)細(xì)胞����,目前已在幾乎所有類型的貼壁、懸浮以及3D培養(yǎng)的細(xì)胞中證明了此種采集方法的可行性����,包括一些處理起來十分困難的樣品,如原代細(xì)胞����,或取自新鮮冷凍和蔗糖處理的復(fù)合組織(如腦)的單個(gè)細(xì)胞。
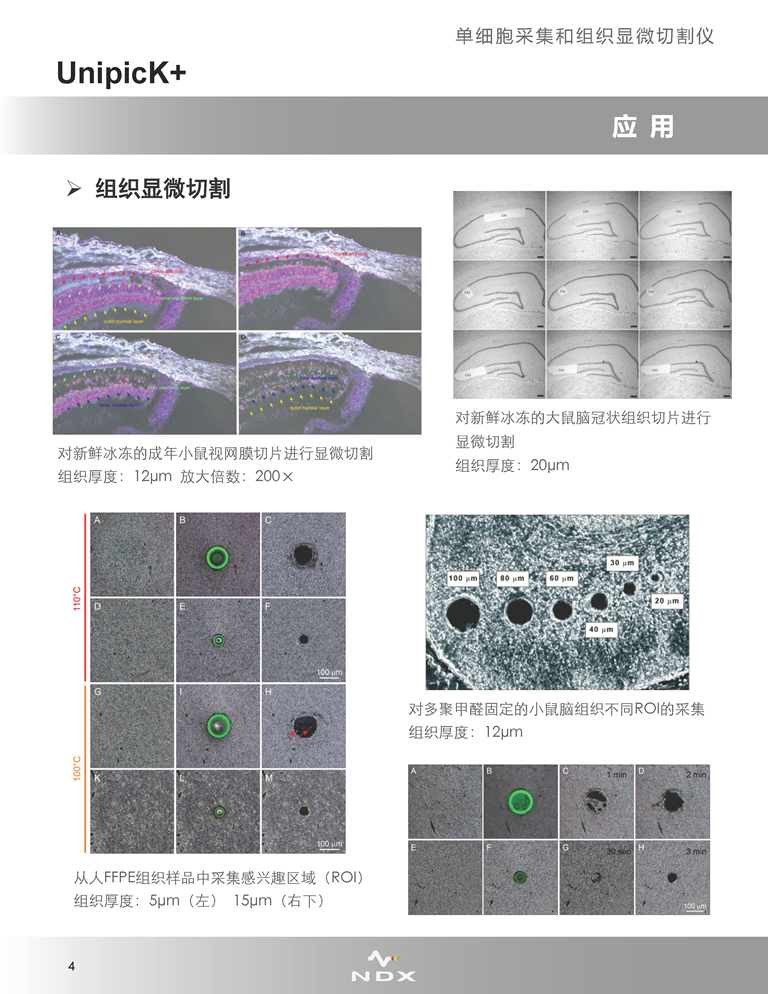
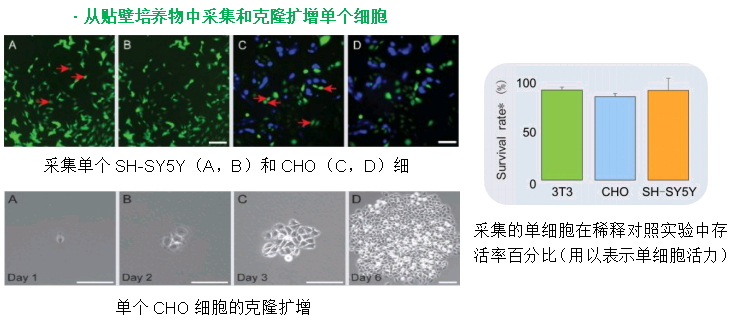
·組織顯微切割
UnipicK+適用于從復(fù)雜異質(zhì)性組織(如腦)中采集得到特定區(qū)域的組織����,即對(duì)目標(biāo)組織區(qū)域進(jìn)行顯微切割操作。
·單細(xì)胞克隆與測序分析
UnipicK+配備有自動(dòng)分配系統(tǒng)����,與下游單細(xì)胞分析及下一代測序操作兼容,可在采集完成后將樣本分配到培養(yǎng)板����、PCR管����、8排管����、48孔板中,方便進(jìn)行后續(xù)的單細(xì)胞克隆擴(kuò)增����、提取核酸進(jìn)行PCR、微陣列和測序分析等����。
|
|
UnipicK+應(yīng)用舉例
|
|
UnipicK+適用的研究領(lǐng)域:
神經(jīng)科學(xué),干細(xì)胞生物學(xué)和單細(xì)胞分析����,癌癥生物學(xué)等領(lǐng)域。
UnipicK+產(chǎn)品特點(diǎn):
1. 數(shù)字化的操作界面����,簡單易懂,無須復(fù)雜的培訓(xùn)即可上手。
2. 在顯微鏡下對(duì)組織切片的目標(biāo)區(qū)域進(jìn)行有效切割����,或從標(biāo)準(zhǔn)細(xì)胞培養(yǎng)板����、培養(yǎng)皿中生長的任何貼壁培養(yǎng)物中收集和沉積單個(gè)細(xì)胞,體積小至15 nl����。
3. 與各種下游單細(xì)胞分析和下一代測序操作兼容,方便提取用于下游組學(xué)研究的高質(zhì)量RNA和蛋白質(zhì)����。
4. 采集過程不涉及輻射、激光����、熱和化學(xué)處理,對(duì)細(xì)胞活性的影響較小����,因此收集后的細(xì)胞具有較高的存活能力,可以用于再培養(yǎng)����;對(duì)細(xì)胞內(nèi)大分子活性和完整性影響也較小����,適合下游單細(xì)胞測序等分析����。
5. 適合于多種倒置顯微鏡。
6. 性價(jià)比高����,因真空負(fù)壓輔助技術(shù)成本低,僅占激光輔助的顯微切割儀成本的一小部分����。
|
|
耗材
|
|
一次性毛細(xì)管單元(DCU):
·由粗(K)壁或薄(N)壁硼硅酸鹽毛細(xì)管制成����;無菌。
·直徑范圍10-100μm����,使用范圍從單細(xì)胞采集、培養(yǎng)細(xì)胞克隆采集����、到特定組織區(qū)域的顯微切割����。
·DCU的內(nèi)徑大致對(duì)應(yīng)于采集區(qū)域的大小����,采集區(qū)域可能會(huì)由于所設(shè)定的真空持續(xù)時(shí)間和強(qiáng)度而有所不同����。
·每包裝6個(gè)。
|
|
|
附件:
通用型支架:
將UnipicK+與幾乎任何類型的倒置顯微鏡連接����,從單細(xì)胞培養(yǎng)到更先進(jìn)的系統(tǒng),使實(shí)驗(yàn)工作更具靈活性����。
|
|
|
通用型載物臺(tái)適配器:
實(shí)現(xiàn)從多種培養(yǎng)裝置中采集和分配樣本:切片到切片,板到板����,切片到板,切片/板到PCR管/8管條/48孔板����。
|
|
|
產(chǎn)品規(guī)格
|
|
界面
|
數(shù)字化操作
|
|
壓力泵最大正壓
|
5 PSI(≈258.6mmHg / 34.5 kPa)
|
|
真空泵最大負(fù)壓
|
10 PSI(≈517.1mmHg / 69.0 kPa)
|
|
壓力持續(xù)時(shí)間
|
0.1 ~ 1.0 s
|
|
樣本兼容性
|
貼壁細(xì)胞����,懸浮細(xì)胞����,3D培養(yǎng)物,新鮮活組織����,新鮮冷凍組織,蔗糖處理組織和固定過的組織等
|
|
樣本分辨率
|
培養(yǎng)的單細(xì)胞和內(nèi)徑20μm的組織切片
|
|
適用組織切片厚度范圍
|
5-300μm
|
|
細(xì)胞存活率
|
可達(dá)95%(數(shù)據(jù)來自于對(duì)3T3����、CHO以及SH-SY5Y細(xì)胞系的評(píng)估)
|
|
一次性毛細(xì)管單元(DCU)規(guī)格
|
10 ~ 100 μm
|
|
線性馬達(dá)單次位移距離
|
1.5 μm
|
|
線性馬達(dá)最大位移距離
|
23.3 mm
|
|
線性馬達(dá)最大位移速度
|
0.30 mm/s
|
|
樣本載體
|
25mm載玻片;
35mm和50mm培養(yǎng)皿����;
96/24/12/6孔培養(yǎng)板;
48孔PCR管����;
微流芯片等
|
|
分配通量
|
可達(dá)48個(gè)樣本
|
|
采集體積
|
DCU20μm:10nl- 2.5μl
DCU30μm:35nl- 3.0μl
DCU40μm:70nl- 5.0μl
(由標(biāo)準(zhǔn)DMEM培養(yǎng)基計(jì)算得出;實(shí)際采集量取決于DCU直徑和樣本粘度)
|
|
采集速度
|
組織切片 - 可達(dá)12個(gè)細(xì)胞/min
細(xì)胞培養(yǎng)物 - 可達(dá)25個(gè)細(xì)胞/min
(預(yù)估的采集速度僅作為參考值����,實(shí)際速度可能與用戶/應(yīng)用相關(guān))
|
|
顯微鏡兼容性
|
可兼容多種型號(hào)的倒置顯微鏡
|
|
參考文獻(xiàn)
|
·Kudo LC, Vi N, Ma Z, Fields T, Avliyakulov NK, Haykinson MJ, Bragin A, Karsten SL. Novel Cell and Tissue Acquisition System (CTAS): microdissection of live and frozen brain tissues.PLoS One. 2012;7(7):e41564. Epub 2012 Jul 24.
·Mannello F, Ligi D, Magnani M. Deciphering the single-cell omic: innovative application for translational medicine.(PMID:23256674) Expert Rev Proteomics [2012]
·Ma Z, Kudo LC, Karsten SL. KuiqpicK: A Novel Instrument for Rapid Collection of Individual Live Cells from Adherent Cultures. J Biomol Tech. 2014 May; 25(Suppl): S25. PMCID: PMC4162253
·Xu MJ, Cooke M, Steinmetz D, Karakousis G, Saxena D, Bartlett E, Xu X, Hahn SM, Dorsey JF, Kao GD. A novel approach for the detection and genetic analysis of live melanoma circulating tumor cells. PLoS One. 2015 Mar 25;10(3):e0123376. doi: 10.1371/journal.pone.0123376. PMID: 25807549
·Lelièvre, S.A., Hodges, K.B., Vidi, P.-A. Application of Theranostics to Measure and Treat Cell Heterogeneity in Cancer (Book Chapter) 2014 Cancer Theranostics
·Surrette C, Shoudy D, Corwin A, Gao W, Zavodszky MI, Karsten SL, Miller T, Gerdes MJ, Wood N, Nelson JR, Puleo CM. Microfluidic Tissue Mesodissection in Molecular Cancer Diagnostics.J Lab Autom. 2016 Nov 18. pii: 2211068216680208. [Epub ahead of print] PMID: 27864340
·Karakas HE, Kim J, Park J, Oh JM, Choi Y, Gozuacik D, Cho YK. A microfluidic chip for screening individual cancer cells via eavesdropping on autophagy-inducing crosstalk in the stroma niche.Sci Rep. 2017 May 17;7(1):2050.
·Chen YC, Baac HW, Lee KT, Fouladdel S, Teichert K, Ok JG, Cheng YH, Ingram PN, Hart AJ, Azizi E, Guo LJ, Wicha MS, Yoon E. Selective Photomechanical Detachment and Retrieval of Divided Sister Cells from Enclosed Microfluidics for Downstream Analyses.ACS Nano. 2017 May 23;11(5):4660-4668.
·Tzu-Keng Chiu, Yang Zhao, Deyong Chen, Chia-Hsun Hsieh, Ke Wang, Wen-Pin Chou, Chia-Jung Liao, Hsin-Yao Wang, Beiyuan Fan, Junbo Wang, Jian Chen, Min-Hsien Wu. A low-sample-loss microfluidic system for the quantification of size-independent cellular electrical property—Its demonstration for the identification and characterization of circulating tumour cells (CTCs).Sensors and Actuators B: Chemical Volume 246, July 2017, Pages 29–37.
·Dorland JM. Variable Response to Chemo therapeutics by a Subpopulation of MCF-7 Breast Cancer Cells. Department of Biomedical Engineering, The University of Texas at Austin, Austin, TX 78712, Engineering Honors Undergraduate Thesis (May 17, 2016)
|
產(chǎn)品彩頁